CONSEIL GENETIQUE ET PROCREATION
Eléments simplifiés d’information sur la génétique
Le corps humain comprend environ 70.000 milliards de cellules ; dans chacune d’elle un noyau renferme le « patrimoine génétique », sortes de gigantesques « livres de recettes » qui permettent d’élaborer toutes les composantes de l’individu et les protéines nécessaires à son bon fonctionnement. Ce patrimoine, identique dans chaque cellule, est composés de 23 paires de chromosomes (23 doubles « livres de recettes»), un des doubles étant hérité du père, l’autre de la mère.
Chaque chromosome est essentiellement constitué par l’ADN (Acide DésoxyriboNucléique), longue chaîne de 3 milliards de molécules appelées « bases » (Adénine, Cytosine, Thymine, Glutamine, ACTG). L’ADN est structuré en régions, appelées « gènes » (un gène = une « recette »), qui contiennent l’information nécessaire à la fabrication d’une ou plusieurs protéines, sous forme d’un « code » formé par des séquences particulières d’ ACTG (les « mots » de chaque « recette »). Il y a environ 25.000 gènes chez l’être humain qui codent pour plusieurs millions de protéines.
Lors de l’activation d’un gène pour un besoin de synthèse de protéine, il y a copie de cette zone de l’ADN sous forme d’un « ARN » (Acide RiboNucléique) dit « messager » « ARNm » ( = on fait une « copie de la recette » pour exécution). Après un certain nombre de transformations, l’ARNm sort du noyau et entre dans le cytoplasme de la cellule pour piloter la synthèse de la protéine demandée ( = la « recette » va dans la « cuisine » pour la réalisation du plat).
Sauf pour le chromosome 23 qui fixe les caractères sexuels, les 2 éléments de chaque paire sont dits « homologues », c'est-à-dire qu’ils présentent la même séquence de gènes ( = « de recettes »), mais dont le contenu peut être légèrement différent : ce sont des « allèles » d’un même gène ( = « variantes de la recette »).
Lors de la fécondation de l’ovule et du spermatozoïde, chaque paire de chromosome se sépare et une nouvelle paire correspondante va être constituée chez l’embryon à partir au hasard d’une des demi paires de la mère (M1ou M2) et d’une des demi paires du père (P1ou P2). Il y a donc à chaque naissance 4 possibilités d’assemblages (M1+ P1, M1 + P2, M2 + P1, M2 + P2).
Les problèmes liés à la maladie de Steinert
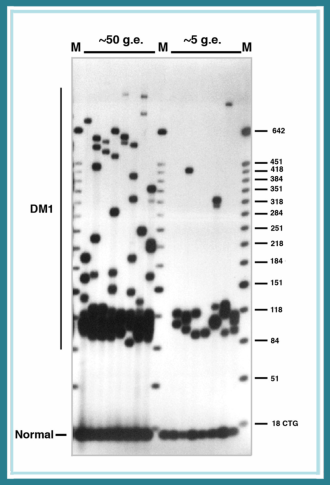
La maladie se manifeste à cause d’une erreur du code du gène DMPK dans la zone « q13 » de l’un des 2 allèles du chromosome N°19 : une des séquences de lettre CTG est répétée plus d’une cinquantaine de fois (jusqu’à des milliers de fois), au lieu d’une trentaine normalement. Lors de la recopie de l’ADN ces répétitions se retrouvent dans l’ARNm, qui devenu top long, ne peut sortir du noyau, s’accumule dans le noyau, forme des agrégats qui vont perturber directement ou indirectement le fonctionnement d’autres ARNm, codant pour d’autres protéines, d’où l’aspect multisystèmique des symptômes (voir Définition de la Maladie de Steinert).
.
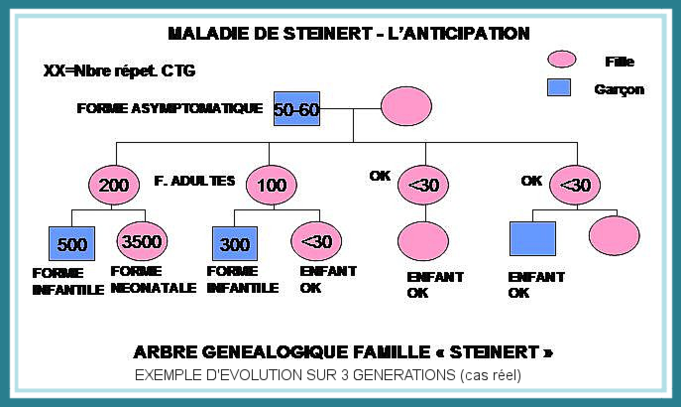
En outre, par un effet « boule de neige », le nombre de répétitions anormales de la séquence CTG a tendance à augmenter à chaque génération (instabilité intergénérationnelle) et, également au cours de la vie du malade (instabilité somatique). Ceci expliquerait l’aggravation et la précocité des symptômes chez les enfants atteints et l’évolution de la maladie au cours du temps, les plus grandes répétitions étant statistiquement associées à une plus grande sévérité et précocité des symptômes.
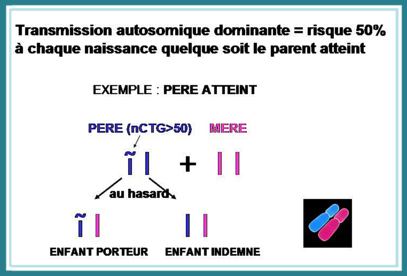
Enfin, la maladie est dite « autosomique dominante », ce qui signifie qu’il suffit qu’un des 2 allèles soit porteur de l’anomalie pour que la maladie apparaisse, autrement dit, il suffit qu’un seul des deux parents (homme ou femme) soit porteur de l’anomalie pour que le risque de transmission existe.
Statistiques sur la transmission
D’après certaines études statistiques qui restent à confirmer :
- si la transmission se fait par un père ayant moins de 100 répétitions CTG, le nombre de CTG augmente chez l’enfant atteint,
- si la transmission est due à un père ayant plus de 500 répétitions CTG, le nombre de répétitions CTG diminue chez l’enfant atteint,
- si la transmission vient d’une mère ayant plus de 500 répétitions CTG, le nombre de CTG augmente chez l’enfant atteint.
Problèmes de fertilité ovarienne : Des études ont montré que la fertilité des femmes atteintes de la Maladie de Steinert était inférieure à la normale : la réserve ovarienne est plus faible, les niveaux d’hormones plus bas, les doses nécessaires pour la stimulation ovarienne plus élevés et les taux de grossesses et de survie d’embryons plus faibles. Il est important que les futures mères atteintes de la maladie soient informées de la possibilité de décroissance précoce des fonctions ovariennes pour qu’elles en tiennent compte dans leurs éventuels projets de procréation.
Avoir un enfant non atteint
Lors de la procréation, si un des 2 parents est porteur de l’anomalie génétique (même s’il n’y a pas de symptôme apparent), la ½ paire du chromosome 19 atteinte a une probabilité d’un sur deux d’être transmise à chaque naissance : dans l’exemple d’assemblage ci-dessus, on voit bien que si par exemple l’allèle P2 est concerné, il apparaît 2 fois sur 4 dans les possibilités d’assemblage.
On ne sait pas encore corriger le défaut de répétitions dans l’ADN, ni empêcher les instabilités intergénérationnelles et somatiques chez une personne atteinte. La possibilité d’avoir un enfant indemne de la maladie (quand on sait à l’avance qu’un des deux parents est atteint) réside alors dans deux méthodes légalement autorisées : le diagnostic prénatal (DPN, dit aussi anténatal) et le diagnostic préimplantatoire (DPI).
DIAGNOSTIC PRENATAL/ANTENATAL (DPN)
Si la fécondation a déjà eu lieu, une biopsie du trophoblaste réalisée dès 12 semaines d’aménorrhée permet de savoir si l’embryon a hérité de la mutation ou pas. Si oui, une interruption médicale de grossesse peut être proposée aux parents.
DIAGNOSTIC PREIMPLANTATOIRE (DPI)
Il s’agit de réaliser une fécondation in vitro et une réimplantation des embryons dépourvus d’anomalies génétiques après contrôle. Le diagnostic génétique est réalisé sur un embryon de 3 jours (8 cellules) dont on aura prélevé une ou deux cellules . Cette technique est autorisée pour la maladie de Steinert, mais elle réalisée dans peu de centres (Paris : hôpital Necker, Clamart : hôpital Béclère, Strasbourg : CHU Schiltigheim, Montpellier : hôpital de Villeneuve, CHU Nantes, CHU Grenoble - information du CHU Grenoble), avec des délais longs (typiquement 2 ans) et de grandes difficultés de réalisation. Le taux de réussite reste relativement faible (15- 20%).
INFORMER LE CERCLE FAMILIAL
Comme il est expliqué ci-dessus, il y a un risque de transmission par adultes porteurs asymptomatiques, avec une aggravation probable de la sévérité de la maladie lorsque l’enfant est atteint. Or, si une personne est diagnostiquée, cela signifie qu’elle a eu un ancêtre porteur de l’anomalie génétique, et donc que d’autres descendants de cet ancêtre commun sont susceptibles d’être également atteints, avec des conséquences potentiellement graves pour leur descendance (notamment le risque cardiaque). C’est pourquoi, bien que ce soit souvent difficile à envisager, il faut informer les autres branches de sa famille de ce problème.
Pour tous les sujets décrits ci-dessus, il est absolument indispensable de prendre conseil auprès d’un médecin généticien.
Bon à savoir : si l’enfant qui naît est indemne de la maladie, il aura une descendance normale (pas de « saut de génération »).
Pour en savoir plus sur la génétique
L’Agence de la Biomédecine a développé un site d’information grand public sur la génétique, notamment liée aux maladies neuromusculaires : « Les clés de la génétique médicale pour tous ».
http://www.genetique-medicale.fr
L'AFM-Téléthon a publié une plaquette "Savoir & Comprendre - Repères" : "Conseil génétique et maladies neuromusculaires". Cliquer ICI
Le médecin est seul habilité à prescrire la prise en charge la mieux adaptée à chaque patient. Les prises en charge décrites sont données à titre informatif comme étant les plus fréquentes et ne sauraient tenir lieu de prescription.
Noter que dans le cas de la maladie de Steinert, les traitements prescrits sont en général pris en charge à 100% par l’assurance maladie.